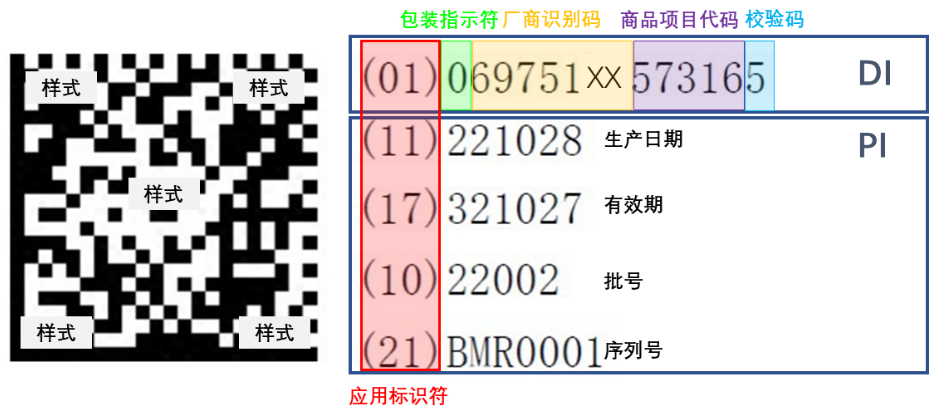
UDI是医疗器械唯一标识(Unique Device Identification)的英文缩写(以下简称“UDI”)。它是对医疗器械在其整个生命周期被赋予的身份标识,是其在产品供应链中的唯一“身份证”。它主要是由数字、字母或符号组成的编码。由产品标识(DI)和生产标识(PI)组成。产品标识码(DI)属于静态信息,它是医疗器械产品在供应链中的身份标识,包含了注册人、备案人、医疗器械型号规格和包装的唯一代码;而生产标识(PI)属于动态信息,它包括医疗器械产品的序列号、批号、生产日期和有效期等,是医疗器械产品的动态附加信息,它与DI联合使用,才能指向特定的唯一的医疗器械产品。完整的UDI如下图所示。
一、UDI的起源
UDI的起源可以追溯到2007年,当时全球医疗器械的使用量迅速增长,但是医疗器械的安全性和效率却受到了挑战。在此背景下,我国于2012年发布《国家药品安全“十二五”规划》,正式启动高风险医疗器械国家统一编码工作,2019年5月发布《医疗器械唯一标识系统规则》,并将UDI要求写入《医疗器械监督管理条例》。2013年,美国FDA和欧洲IMDRF同年分别推出UDI规则和IMDFR UDI指南,最终目的是建立一种全球统一的医疗器械标识体系,使得医疗器械的管理和使用更加安全和高效。
二、UDI的样式
我国一共有三个UDI发码机构,分别是中关村工信二维码技术研究院(MA码)、中国物品编码中心(GS1码)和阿里健康科技(中国)有限公司的码上放心平台(AHM码)。GS1码同时也是国际通用的发码机构。医疗器械企业通过申请报备,需按照法规要求将UDI码打印在产品上,患者和医疗机构可以通过扫码确认产品的合法来源以及跟踪使用情况。
UDI的样式分为二维码、一维码和射频识别(RFID)标签,这也是UDI的载体。虽然表现形式不同,但是通过不同平台和设备扫描获取的产品信息是一样的。有些产品会使用多种载体以满足不同的使用需求。
根据《医疗器械唯一标识系统规则》,UDI码根据不同的产品风险分批分类进行部署实施,相关公告由国家药监局、国家卫生健康委和国家医保局三部门联合发布,目前一共发布了三批。
三、UDI的使用
目前我国法规要求UDI的DI部分须在国家药品监督管理局的医疗器械唯一标识数据库申报登记,患者、使用单位和监管部门通过扫描打印在医疗器械上或者标签上的二维码或者条形码(一维码)等形式在相关的平台上查询医疗器械的重要信息,包括生产企业、产品名称、规格型号、生产日期、有效期、灭菌日期和批号等。常用的扫码平台有中国物品编码中心和“码上放心”平台等。
四、UDI的好处
UDI的主要目的是提高医疗器械的全周期可追溯性。通过提供UDI,可以帮助监管机构和医疗机构更好地管理医疗器械的生产、使用情况,从而提高安全有效性。
此外,UDI还可以帮助制造商更好地管理医疗器械的生产和分销过程,从而提高生产效率和降低成本。例如,某个医疗器械存在质量问题或者被回收了,医疗机构可以通过UDI标识来快速定位并处理这个问题产品。UDI标识还可以帮助医疗机构更好地进行库存管理和设备维护,从而提高经营、使用单位对医疗器械的管理效率和管理质量。
对于监管部门来说,通过UDI标识可以更好地追溯医疗器械全生命周期的信息,帮助监管机构加强对医疗器械全生命周期的监管。